
Sumber: The Biology Notes
Tujuan Pembelajaran
1. Mengidentifikasi larutan penyangga atau larutan buffer
Larutan Penyangga
- Larutan penyangga (larutan buffer) adalah larutan yang mampu menyangga atau mempertahankan pH sehingga tidak berubah pada penambahan sedikit larutan asam ataupun sedikit larutan basa
- Macam larutan penyangga:
1. Larutan penyangga asam yaitu larutan asam lemah dengan basa konjugasinya (dalam bentuk senyawa garam)
(Masih ingat apakah senyawa asam / basa konjugasi kan? Atau lihat materi tersebut kembali)

Ilustrasi - Larutan Penyangga Asam adalah larutan asam lemah dengan basa konjugasinya
Sumber: www.chemcollective.org
Contoh: Larutan CH3COOH + CH3COONa
Penjelasan: CH3COOH adalah asam lemah, dan CH3COONa adalah senyawa garam yang mengandung basa konjugasinya CH3COOH yaitu ion CH3COO—. Sehingga bisa dikatakan larutan tersebut adalah larutan asam lemah dengan basa konjugasinya (disebut sebagai larutan penyangga asam)
Rumus menghitung pH larutan penyangga asam:
\[[H]^+\:=\:Ka\:.\:\frac{a}{bk}\]
Keterangan:
a : mol asam lemah
bk : mol basa konjugasi (garam)
2. Larutan penyangga basa yaitu larutan basa lemah dengan asam konjugasinya (dalam bentuk senyawa garam)
Contoh: Larutan NH4OH + (NH4)2SO4
Penjelasan: NH4OH adalah basa lemah, dan (NH4)2SO4 adalah senyawa garam yang mengandung asam konjugasinya NH4OH yaitu ion NH4+. Sehingga bisa dikatakan larutan tersebut adalah larutan basa lemah dengan asam konjugasinya (disebut sebagai larutan penyangga basa)
Rumus menghitung pH larutan penyangga basa:
\[[OH]^-\:=\:Kb\:.\:\frac{b}{ak}\]
Keterangan:
b : mol basa lemah
ak : mol asam konjugasi (garam)
Contoh Soal dan Pembahasan
Soal 1
Periksalah campuran berikut termasuk bersifat penyangga ataukah tidak. Jika iya tuliskanlah komponen penyangganya:
1. 50 mL larutan NH4Cl 0,1 M + 50 mL larutan NaOH 0,1 M
2. 50 mL larutan NH3 0,1 M + 50 mL larutan NH4Cl 0,1 M
3. 50 mL larutan H2SO4 0,1 M + 100 mL larutan NH3 0,2 M
1. 50 mL larutan NH4Cl 0,1 M + 50 mL larutan NaOH 0,1 M
Campuran tersebut tidak bersifat penyangga, karena NH4Cl adalah senyawa garam, sedangkan NaOH adalah senyawa basa kuat. Sehingga campuran tersebut bukanlah campuran asam lemah dengan basa konjugasinya ataupun basa lemah dengan asam konjugasinya
2. 50 mL larutan NH3 0,1 M + 50 mL larutan NH4Cl 0,1 M
Campuran tersebut adalah bersifat penyangga basa, karena NH3 adalah senyawa basa lemah, sedangkan NH4Cl adalah senyawa garam yang mengandung asam konjugasinya NH3 yaitu NH4+. Dengan kata lain campuran tersebut adalah campuran basa lemah dengan basa konjugasinya
Komponen penyangganya adalah NH3 + NH4+
3. 50 mL larutan H2SO4 0,1 M + 100 mL larutan NH3 0,2 M
Berbeda dengan soal sebelumnya, campuran ini harus kita reaksikan lebih dahulu.
| Reaksi | H2SO4 | + | 2NH3 | → | (NH4)2SO4 | + | 2H2O |
| Data (Gunakan rumus molaritas) |
50mL 0,1M | 100mL 0,2M | |||||
| Jumlah mol semula | 5 mmol | 20 mmol | |||||
| Jumlah mol bereaksi (Gunakan rumus perband koef reaksi) |
5 mmol | 10 mmol | 5 mmol | 10 mmol | |||
| Akhir reaksi (Sisa) | habis | 10 mmol | 5 mmol | 10 mmol |
Campuran tersebut bersifat penyangga basa, karena pada saat reaksi berakhir zat yang ada adalah NH3 yaitu senyawa basa lemah dan (NH4)2SO4 yaitu senyawa garam yang mengandung asam konjugasinya NH3 yaitu NH4+. Dengan kata lain pada saat reaksi sudah berakhir larutannya menjadi campuran basa lemah dengan asam konjugasinya (disebut sebagai larutan penyangga basa).
Komponen penyangganya adalah NH3 + NH4+
Soal 2
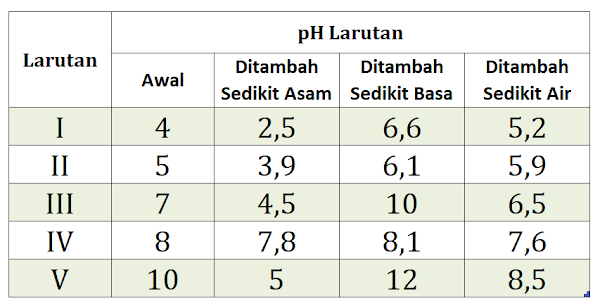
Berikut ini adalah data percobaan penambahan sedikit larutan asam, basa serta air ke dalam lima buah larutan:
Dari kelima larutan tersebut, prediksikan larutan manakah yang bersifat penyangga (buffer).
Larutan penyangga adalah larutan yang mampu mempertahankan pH pada penambahan sedikit larutan asam, larutan basa ataupun sedikit pengenceran. Berdasarkan kriteria tersebut maka larutan yang bersifat sebagai larutan penyangga adalah larutan IV.
Mengapa?
Perhatikan perubahan pH larutan IV, bandingkanlah pH awal dengan pH saat ke dalam larutan tersebut ditambah sedikit larutan asam, larutan basa ataupun sedikit air. Bukankah perubahannya adalah yang paling kecil atau sedikit? Artinya pH larutan IV hampir tetap (tidak berubah).
(Semoga bermanfaat - Ahmad Fata)
Tonton Video "Mengenal Larutan Penyangga di Kimia Fata Channel

Posting Komentar
Terimakasih telah berkenan memberikan komentar pada artikel ini